Funzionamento delle batterie
Molto in breve, il funzionamento delle batterie si ottiene “creando” delle cariche elettriche e “trasportandole” ai due estremi (poli) della batteria per attrazione chimica.
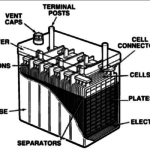
La batteria più semplice è costituita da una piastra di piombo e da una piastra di biossido di piombo (PbO2=un atomo di piombo e due di ossigeno) immerse in una soluzione (circa al 35%) di acido solforico.
L’acido solforico (H2SO4) è composto da due atomi di idrogeno H2++ e un complesso SO4– (un atomo di zolfo e 4 di ossigeno). Se l’acido non è ancora scisso, queste due parti sono unite da attrazione elettrica, dal momento che il complesso SO4 presenta due elettroni in eccesso (diciamo che ha due cariche negative), mentre H2 “vuole appropriarsi” di due elettroni (diciamo che ha due cariche positive).
Nel momento in cui l’acido viene scisso per il fatto di essere sciolto in acqua, queste due opposte cariche divengono libere. Qui entra in gioco l’attrazione chimica delle lastre di piombo.
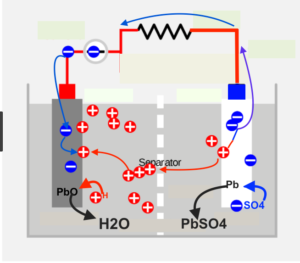
Il complesso SO4 si unisce alla lastra di piombo puro, liberando i suoi due elettroni, generando solfato di piombo (PbSO4), mentre sulla lastra di biossido (PbO2) i due atomi di idrogeno “si appropriano” dell’ossigeno generando una molecola di acqua (H2O) che va a diluire l’acido.
L’ossigeno “strappato dal piombo lasci due “cariche positive” cioè la mancanza di 2 elettroni nella lastra di piombo. Quando si chiude il circuito, i due elettroni che abbiamo visto essere depositati sulla piastra di piombo puro (negativa) fluiscono come corrente e vanno a compensare le due carenze di elettroni sulla piastra positiva.
In realtà c’è anche un processo secondario, che porta alla creazione di solfato di piombo anche sulla piastra positiva (ma non è essenziale per aver un’idea del funzionamento).
Esistono anche altre reazioni secondarie, controproducenti, la cui entità dipende dalla qualità della batteria
PROCESSO DI CARICA
Tutte le reazioni che abbiamo visto si invertono nel processo di carica. In particolare l’acqua (H2O) si scinde in idrogeno e ossigeno (elettrolisi dell’acqua). Nelle moderne batterie questa produzione è ridotta grandemente, e i gas si ri-combinano rigenerando acqua senza significativo bisogno di sfogo all’esterno (batterie “ermetiche” o “a ricombinazione” o “VRLA” (Valve Regulated Lead-Acid, con riferimento alla valvola di sicurezza comunque presente)